Aqua régia: propriedades e aplicações no processo de refino
Altamente corrosiva e muito volátil, a aqua régia (do latim, “água real”) é um composto químico formado a partir da mistura dos ácidos clorídrico e nítrico na proporção de 3:1 (em volume), respectivamente. Seu uso é documentado a partir do século XIV, em experimentos conduzidos por alquimistas e químicos da época que buscavam compostos como a pedra filosofal, o solvente universal ou a transmutação de elementos. Já na química atual, esse reagente é muito utilizado em procedimentos analíticos como responsável por abrir/digerir amostras, em processos galvânicos ou como produto de limpeza de vidrarias de laboratórios contaminadas com compostos orgânicos ou metálicos.

Figura 1. Béqueres contendo aqua régia (à esquerda) e um béquer contendo aqua régia + ouro (à direita). Fonte: Oficina 70.
Obtenção e características
Conforme mencionado anteriormente, para produzir aqua régia é necessário apenas misturar dois reagentes: o ácido clorídrico (HCl) e o ácido nítrico (HNO3). Esses ácidos – que são fortes e são misturados em sua forma concentrada – são adicionados em uma proporção em volume de 3 HCl para 1 HNO3, ou seja, se quisermos preparar uma solução de aqua régia e dispomos de 3 mL de ácido clorídrico, necessitamos de mais 1 mL do ácido nítrico para completar o processo.
Outra característica importante da aqua régia é seu poder oxidante e corrosivo, proveniente da mistura ácida que a forma, e tais características a torna um produto químico perigoso, que deve ser manuseado em locais apropriados e com a devida proteção (óculos de segurança, jaleco e luvas). Assim, o seu diagrama de Hommel (Figura 2), utilizado para mostrar as propriedades e os riscos de uma substância em uma escala numérica de 0 a 4, possui os seguintes parâmetros:
- Perigo para saúde (azul): risco nível 3, que caracteriza um produto severamente perigoso e danoso.
- Inflamabilidade (vermelho): risco nível 0, que caracteriza um produto que não entra em ignição.
- Reatividade (amarelo): risco nível 2, que caracteriza um produto que realiza uma reação química violenta quando é exposto a pressões ou temperaturas elevadas.
- Riscos específicos (branco): é um produto corrosivo.

Figura 2. Diagrama de Hommel da aqua régia.
A reação envolvida na obtenção da aqua régia envolve dois ácidos incolores, o que gera, inicialmente, uma mistura também incolor. Contudo, após alguns segundos, nota-se a mudança de coloração para um amarelo/laranja característico desse composto, e isso se dá pela formação de cloreto de nitrosilo (NOCl), conforme mostra a equação química abaixo.
Figura 3. Equação química de formação e decomposição da aqua régia.
Além disso, a reação química acima nos mostra, ainda, que ocorre o desprendimento de gás após a reação dos ácidos clorídrico e nítrico. A volatilidade dos produtos dessa reação gera perdas no sistema, o que diminui a “potência” e a reatividade da aqua régia, já que a decompõe. Assim, por esse motivo, este reagente deve ser preparado momentos antes de seu uso, já que o seu armazenamento pode ocasionar alteração no conteúdo químico do frasco (ou seja, quando for utilizado não reagirá da forma esperada) e causar danos ao material em que foi armazenado, caso esse não tenha sido escolhido de forma ideal.
Vale destacar, também, que o manuseio da aqua régia deve ser realizado sempre em uma capela de exaustão, já que os gases liberados podem reagir com o oxigênio do ar e formar dióxido de nitrogênio (NO2), um gás altamente tóxico de coloração amarronzada. A reação em questão pode ser observada na Figura 4 abaixo.
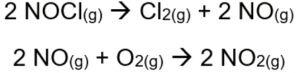
Figura 4. Reações químicas envolvendo os produtos da decomposição da aqua régia. A primeira reação indica a decomposição do cloreto de nitrosilo em gás cloro e monóxido de nitrogênio, enquanto a segunda reação mostra a reação do monóxido de nitrogênio com o oxigênio do ar, formando o dióxido de nitrogênio.
A aqua régia no processo de refino de metais
Uma das características mais marcantes da aqua régia é a sua capacidade de dissolver metais nobres (que são pouco reativos) com facilidade. Logo, o ouro, a platina e o paládio sólidos podem ser convertidos em solução quando esse poderoso reagente é utilizado. A principal explicação para a dissolução desses metais nobres pela aqua régia se dá pela atuação em separado dos dois ácidos constituintes, que realizam a oxidação do metal e a “captura” dos cátions em uma molécula solúvel (função dos ácidos nítrico e clorídrico, respectivamente). A seguir, explicaremos de forma mais detalhada esse processo, mostrando também as reações químicas envolvidas.
Dissolução do ouro por aqua régia
A etapa de dissolução de ouro ocorre após a retirada de toda prata do sistema, realizada a partir da adição de ácido nítrico. Assim, como o ouro não reage com esse ácido, a mistura apresenta duas fases (o ouro sólido e a solução de nitrato de prata) que são separadas por filtração à vácuo.
Feito isso e garantindo a retirada de todo resquício de prata, o ouro sólido restante é tratado com a aqua régia. Para tanto, costuma-se utilizar 3 mL de HCl para cada grama de ouro. Porém, sabe-se que o ouro também não reage com o ácido clorídrico e, portanto, a adição do ácido nítrico se faz essencial. A adição deste ácido deve ser feita aos poucos, e normalmente é utilizado 1 mL para cada grama de ouro.
Em seguida, com a adição dos ácidos que compõem a aqua régia, a reação tem início: o ácido nítrico oxida uma pequena parcela do ouro sólido, transformando-o em Au3+, que reage, então, com o ácido clorídrico, responsável por “doar” ao cátion metálico os íons cloro, formando um íon complexo de ouro solúvel de coloração laranja intensa denominado íon tetracloroáurico, conforme mostram as Figuras 5 e 6.
Figura 5. Reação de oxidação do ouro (Au0 -> Au3+) promovida pelo ácido nítrico.
Figura 6. Complexação dos cátions de ouro pelos ânions cloreto, formando um composto de ouro solúvel.
Como a reação entre os cátions de ouro e os cloretos é uma reação em equilíbrio que favorece a formação de [AuCl4]-, cada vez mais íons Au3+ são liberados no sistema a partir da oxidação promovida pelo ácido nítrico. Logo, ao final do processo, todo o ouro se encontra em solução e o processo de refino pode ser continuado. Todo esse processo pode ser observado na Figura 7.

Figura 7. Processo da dissolução de ouro metálico no refino: (1) solução de AgNO3 resultante da dissolução da prata com ácido nítrico; (2) ouro sólido retido no papel filtro durante a filtração da solução de Ag; (3) ouro sólido em reação com a aqua régia; (4) ouro totalmente dissolvido.
Figura 8. Equação química global do processo de dissolução do ouro por aqua régia.
Esse processo ocorre de maneira análoga nas etapas de dissolução dos outros metais, como platina e paládio, visto que a função da aqua régia em ambos os casos permanece inalterada.
Siga-nos no Instagram (@8_metais) e curta nossa página no Facebook (8metais) para mais conteúdos como esse!
Por Sabrina Santana Klabacher






Comentários