A formação de complexos na química do refino de metais
A química do refino de metais está repleta de transformações em cada um de seus processos. Um sólido inicialmente prateado pode se tornar, a partir de uma série de reações, um líquido verde, um sólido amarelo e até mesmo um gás. Essas mudanças de estado físico e de coloração são resultados das diversas reações químicas promovidas durante as etapas de purificação de metais. Estas geram produtos e subprodutos com diferentes propriedades e características visuais.
Alguns dos compostos mais importantes formados nesse processo são os complexos. Eles pertencem a uma categoria de compostos inorgânicos com propriedades e aplicações variadas. No processo de refino, esses complexos estão presentes na precipitação dos metais em compostos pouco solúveis e na formação de espécies solúveis que colorem a solução, compondo uma série de etapas que têm como finalidade a separação de contaminantes e a consequente obtenção de um metal com pureza 99,9+%.
O que são complexos?
Na química, complexos (ou compostos de coordenação) são substâncias formadas por ligantes e um íon central metálico que formam uma estrutura interligada. A disposição é tridimensional e complexa, capaz de conferir uma série de propriedades interessantes ao composto final obtido. Esses ligantes interagem com o íon central por meio da doação de pares de elétrons, estabelecendo algumas unidades de ligações covalentes que dependem do chamado número de coordenação do átomo central.
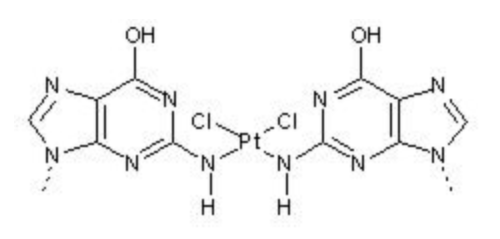
Figura 1. Complexo cisplatina (central) em ligação com outros compostos.
Para compreender melhor o significado dessa definição, imagine uma eleição para presidente. Um candidato tem a atenção de certa quantia de eleitores, que se atraem pelas propostas de acordo com os temas e o que podem oferecer de bom à sociedade. No dia da eleição, parte desses eleitores votarão – ou se ligarão – efetivamente ao candidato. Isso acarretará a maior proximidade dessas pessoas com a figura central, exigindo mudanças e o cumprimento das propostas realizadas no período eleitoral. Da mesma forma são os complexos: podemos imaginar o candidato à presidência como o íon metálico central, enquanto os ligantes são os eleitores que votaram e estão conectados e esse candidato por certas concessões e exigências. No caso dos complexos, as “concessões e exigências” são os pares de elétrons compartilhados. Poderíamos imaginar, também, o número de coordenação desse íon central como a quantidade máxima de votos que o candidato poderia receber.
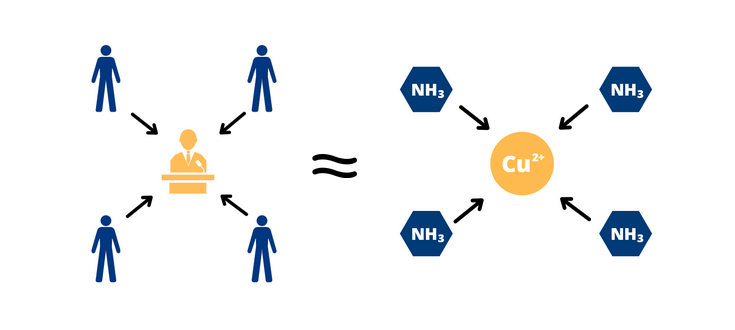
Figura 2. Analogia visual sobre complexos. À esquerda, observamos os eleitores (ligantes) conectados ao candidato (elemento central) em que votaram; à direita, observamos os ligantes químicos (amônia) conectados ao íon central (cobre). Nesse caso, o presidente poderia receber até 4 votos, enquanto o íon central metálico poderia receber apenas 4 ligantes (número de coordenação = 4).
Há uma enorme quantidade de estruturas complexas conhecidas na química, e as formas que podem formar um composto final são enormes. Na química analítica, por exemplo, podemos obter complexos cujo ligantes são orgânicos (como o EDTA) ou inorgânicos (como a amônia). Cada ligante confere uma diferente propriedade ao complexo, seja na geometria espacial da molécula ou na seletividade em algumas reações químicas.
Alguns exemplos de aplicações importantes desses compostos de coordenação são na medicina (como a cisplatina – Figura 1 -, a qual atua como agente quimioterápico), na indústria (como para pigmentos de tintas), na bioquímica (na molécula de hemoglobina, que auxilia na respiração), entre vários outros.
Complexos no refino de metais
Os complexos são muito importantes no processo de refino de metais, já que possibilitam a separação dos compostos metálicos de contaminantes e garantem uma pureza elevada. Destacamos alguns desses exemplos abaixo:
Precipitação da platina
A reação de precipitação da platina envolve dois tipos de complexos desse metal: um solúvel e outro pouco solúvel, o qual acaba precipitando. Nesse processo, há uma solução amarronzada escura que contém o complexo [PtCl6]2-, que é solúvel. Com a adição de uma solução saturada de cloreto de amônio (NH4Cl), ocorre a formação de um complexo insolúvel de coloração amarelada, [(NH4)2PtCl6], que precipita e pode ser separada do restante do líquido. Dessa forma, é possível prosseguir com o refino da platina por calcinação.

Figura 3. Formação do complexo hexacloroplatinato de amônio (sólido amarelo) e a posterior calcinação e formação de platina metálica.
Precipitação do paládio
O paládio é complexado, precipitado e retirado pela adição de um reagente específico geralmente após a separação desse metal da platina. Há algumas formas de se realizar esse processo, como pela adição de hipoclorito de sódio/clorato de sódio/gás cloro ou pela dimetilglioxima (mais conhecida como DMG).
A precipitação e formação do complexo sólido de paládio pelo DMG é uma das mais interessantes, já que pode ser um processo seletivo quando realizado sob as condições corretas. Quando o meio está ácido, esse regente precipita apenas o paládio em solução, formando um sólido amarelo-intenso Pd(DMG)2, que pode ser posteriormente calcinado para obtenção da sua forma metálica em pó.
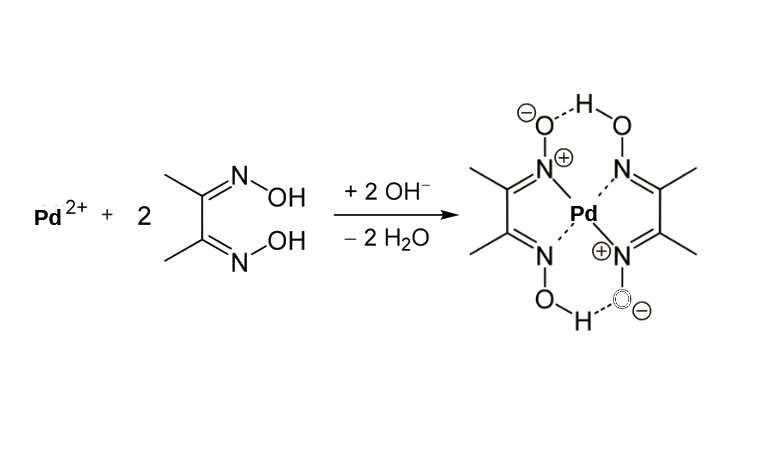
Figura 4. Reação de complexação e formação do composto Pd(DMG)2.

Figura 5. Aparência do complexo de paládio formado pela adição da dimetilglioxima. Fonte: Química Analítica Quantitativa Inorgânica UFRJ.
Decapagem de produtos banhados a ouro para recuperação de lixo eletrônico
A formação de compostos de coordenação no tratamento de lixo eletrônico contendo ouro acontece logo no início do processo, a partir da decapagem das peças banhadas. Para isso, utiliza-se uma solução decapante, formada por metanitrobenzenosulfonato de sódio (O2NC6H4SO3Na), carbonato de potássio (KCO3), cianeto de potássio (KCN) e acetato de chumbo (Pb(CH3COO)2). Essa solução dissolve o ouro sólido e forma um complexo aquoso de ouro de fórmula [Au(CN)2]- e coloração alaranjada. Para saber mais sobre esse processo, clique aqui!

Figura 6. Aspecto antes e depois da decapagem do ouro na superfície dos resíduos.
Com isso, conhecemos mais as substâncias presentes no processo de refino de metais e como elas são essenciais para o prosseguimento deste. E você, conhecia os complexos e suas aplicações?
Siga-nos no Instagram (@8_metais) e curta nossa página no Facebook (8metais) para mais conteúdos como esse!






Comentários