Metais de sacrifício
A reatividade dos compostos químicos influencia diretamente o rumo das reações químicas, os produtos formados, como e se acontecem efetivamente, conferindo diferentes propriedades para diferentes produtos. Um dos exemplos que são mais lembrados quando falamos de reatividade são as reações de oxirredução, as quais envolvem a transferência de elétrons entre os reagentes envolvidos no processo: aquele metal que possuir maior tendência de doar elétrons é aquele mais reativo, ou seja, mais capaz de reagir com o seu meio. E é esse fato que está presente em quase todas as reações realizadas nas áreas de galvanoplastia e metalurgia, já que reações redox são muito comuns em processos de precipitação, redução e solubilização dos metais durante o processo de refino, por exemplo.

Figura 1 – Metal corroído.
No entanto, a oxidação e os materiais metálicos estão conectados a um conceito chamado corrosão – o qual, inclusive, foi tratado com mais detalhes em janeiro de 2023 aqui no blog. Esse processo natural pode se tornar um problema dependendo de onde está localizado, e por isso a ciência possui algumas soluções gerais para recuperar peças deterioradas pelo fenômeno e como preveni-lo. Uma dessas formas de proteção contra a corrosão é a utilização de metais de sacrifício, técnica muito comum e aplicada nos dias de hoje em vários setores.
Afinal, o que são os metais de sacrifício?
Metais de sacrifício nada mais são do que compostos metálicos relativamente reativos com elevado potencial de oxidação – e, portanto, com forte propensão à corrosão quando expostos em ambientes específicos – que são deteriorados ao invés do metal que se deseja proteger. Dessa forma, o metal de sacrifício, após sofrer a oxidação, forma uma camada protetora sobre a camada a ser protegida, impedindo que esta entre em contato com o ambiente corrosivo e estendendo, assim, seu tempo de vida.
Esse tipo de prevenção à corrosão é um tipo de proteção catódica, a qual normalmente é empregada em estruturas submersas e/ou enterradas ou em ferragens. Nela, o metal de sacrifício, que possui maior potencial de oxidação, torna-se o polo positivo (ânodo), e o metal protegido se torna o polo negativo (cátodo), tal qual uma célula eletroquímica. Por isso, a perda de elétrons acontece no chamado ânodo de sacrifício e a corrosão tem início em sua superfície de forma espontânea.
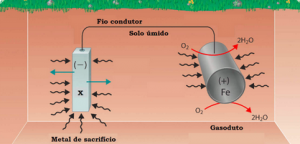
Figura 2. Exemplo de um sistema contendo um metal de sacrifício. Fonte: Adaptado de https://2012books.lardbucket.org/.
Normalmente, os metais mais utilizados para se tornarem ânodos de sacrifício são o zinco, alumínio e magnésio, que possuem potenciais de oxidação iguais a +0,76 V, +1,66 V e +2,37 V, respectivamente. Cada um possui particularidades que tornam sua aplicação melhores em cada setor e, portanto, antes de escolher um metal de sacrifício é essencial entender as suas propriedades e as características do meio em que será adicionado. O zinco, por exemplo, é muito aplicado em ambientes de água salgada, enquanto o magnésio é mais usado em ambientes de água doce.
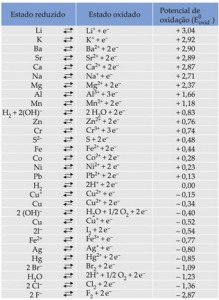
Figura 3 – Tabela de potenciais de oxidação. Fonte: Colégio Web.
Algumas aplicações
As inúmeras vantagens do uso dos metais de sacrifício como forma de proteção contra a corrosão – as quais incluem a não necessidade do uso de energia elétrica para a sua realização, facilidade de instalação e menor custo em comparação a outros métodos – fazem com que essa proteção catódica seja aplicada em uma série de locais e sistemas propícios à corrosão. Alguns exemplos comuns são a utilização em cascos de navios, tanques e outros materiais subterrâneos, refinarias e gasodutos, plataformas, materiais de aço e/ou ferro, entre vários outros.
Vale ressaltar, porém, que como o metal de sacrifício sofre corrosão, sua troca deve ser feita de tempos em tempos a fim de continuar a proteção ao metal base.
Siga-nos no Instagram (@8_metais) e curta nossa página no Facebook (8metais) para mais conteúdos como esse!
Por Sabrina Santana Klabacher






Comentários