Ácidos no refino de metais: características e utilidades
Ácidos são reagentes químicos muito usados no processo de refino de metais. Uma aplicabilidade particular é durante as etapas de dissolução para posterior purificação de cada composto. A dissolução da prata em ácido nítrico e a dissolução do ouro em aqua régia (mistura dos ácidos nítrico e clorídrico), por exemplo, são casos conhecidos.
Mas você sabe o porquê de esses reagentes serem tão utilizados para tal finalidade? Quais são as características intrínsecas desses compostos capazes de conferir a eles tais propriedades? Para responder essas e outras questões, acompanhe o artigo abaixo!

Figura 1. Dissolução de ouro metálico em aqua régia.
O que são os ácidos?
Desde as antiguidades Ocidental e Oriental, o termo “ácido” esteve intimamente interligado com a propriedade sensorial. Isso acontece porque esses compostos apresentam com frequência um sabor azedo. A partir do avanço das teorias científicas e do maior entendimento da química desses compostos, a definição de ácido foi se tornou cada vez mais completa e precisa.
Hoje em dia os ácidos podem ser classificados tanto como substâncias que recebem pares de elétrons (pela Teoria de Lewis) quanto como substâncias que doam íons H+ (pela Teoria de Brønsted-Lowry), podendo ser inorgânicos ou orgânicos. São alguns exemplos de ácidos: ácido nítrico (HNO3), ácido clorídrico (HCl), ácido sulfúrico (H2SO4), ácido acético (CH3COOH), ácido fórmico (CH2O2), entre outros.
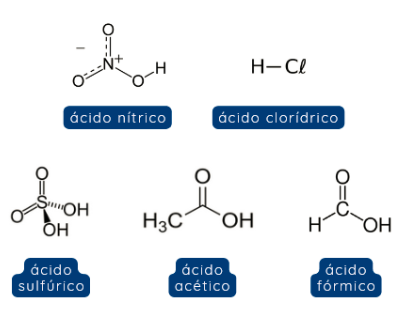
Figura 2. Fórmulas estruturais de alguns ácidos.
Propriedades dos ácidos
As substâncias ácidas podem ser classificadas de acordo com várias categorias, tais como composição (hidrácidos e oxiácidos) e força (ácidos fortes, fracos e moderados). Porém, a categoria mais importante entre os ácidos usados na dissolução de metais é seu poder de oxidação. A maioria dos compostos usados para essa finalidade possuem elevado potencial de oxidação. Isso significa que os ácidos possuem grandes chances de retirar um elétron da substância que reage com ele, num processo químico conhecido como oxirredução. Por esse motivo, os ácidos oxidantes normalmente não liberam hidrogênio no processo de dissolução de metais, já que o valor de seu potencial E0 é positivo e maior do que dos metais. Você pode consultar uma tabela com os valores do potencial de redução de algumas espécies químicas aqui.

Figura 3. Reações de dissolução de metais com ácido oxidante (HNO3) e não oxidante (HCl). Observa-se que, no primeiro caso, não ocorre a formação de gás hidrogênio, já que a espécie oxidante é o íon nitrato; já no segundo caso, o agente oxidante é o íon H+ e, portanto, forma-se H2.
Os ácidos nítrico (HNO3), perclórico (HClO4) e sulfúrico são exemplos de ácidos oxidantes.
Utilização no refino de metais
Assim, conhecendo as características dos ácidos mencionadas, é possível compreender o porquê de sua utilização no refino de metais ser tão essencial e presente nos processos químicos. A maioria dos ácidos usados são muito oxidantes e, portanto, têm uma elevada capacidade de provocar a oxidação daqueles compostos que reagem com ele (ou seja, possuem muita facilidade de receber elétrons). Quando entram em contato com um metal, por exemplo, realizam uma reação de oxirredução e os elétrons são transferidos do metal para o ácido, formando novos compostos após o término da reação, incluindo o metal dissolvido. Um clássico exemplo é a dissolução de cobre metálico em ácido nítrico:

Figura 4. Reação de dissolução do cobre metálico em ácido nítrico. A coloração azul intensa é a solução de cobre dissolvido – Cu(NO3)2 -, enquanto a coloração amarronzada é o gás NO2 desprendido da reação.
Assim, a quase a totalidade das reações de dissolução dos metais nobres segue este mesmo princípio: o ácido com muito poder oxidante retira os elétrons do metal, e então este sai de sua forma neutra e passa a ter carga positiva. Então, a quantidade de ácido a ser adicionada é proporcional à quantidade de metal que ele reage. Isso significa que o processo de dissolução é completo quando obedece-se às proporções estequiométricas da reação.
Mesmo assim, é válido ressaltar que nem todos os metais – especialmente os nobres – dissolvem facilmente em meio ácido. A platina e o ródio, por exemplo, não são facilmente oxidados, e normalmente sua dissolução é promovida apenas em meios não tão convencionais. Outro exemplo é o ouro, o qual não dissolve em ácido nítrico e necessita também da presença do ácido clorídrico (gerando a aqua régia) para que saia completamente de sua forma sólida.
Todos esses fatores dependem da reatividade do metal e dos potenciais de redução e oxidação das espécies envolvidas: se a reação não for termodinamicamente favorável, ela não ocorre. Por esse motivo, é essencial conhecer a composição da mistura a qual se deseja separar e purificar a fim de se utilizar os reagentes químicos adequados.
Siga-nos no Instagram (@8_metais) e curta nossa página no Facebook (8metais) para mais conteúdos como esse!






Comentários