Ácido Sulfúrico: propriedades e aplicações
Você com certeza já ouviu falar do ácido sulfúrico, um dos compostos mais importantes e conhecidos mundialmente. Seja na fabricação de explosivos e de baterias ou na condução de análises químicas e metalúrgicas, as características e propriedades desse composto o tornam difundido nas mais diversas áreas. Quer conhecer mais sobre o versátil ácido sulfúrico? Acompanhe o texto do mês do blog 8Metais!

Figura 1. Embalagem do ácido sulfúrico da fabricante Synth.
Características e obtenção do ácido sulfúrico
O ácido sulfúrico (também conhecido como ácido de bateria, óleo de vitríolo ou sulfato de hidrogênio) é um composto inorgânico de fórmula molecular H2SO4. Ele é líquido em condições normais de temperatura e pressão, incolor e de odor forte. Sua temperatura de fusão é descrita como sendo 10,49 ºC, enquanto sua temperatura de ebulição é 340 ºC.
De acordo com a classificação química de Arrhenius, esse composto é caracterizado como um oxiácido forte. Quando diluído em água, libera íons H+ (ou H3O+ – íon hidrônio) no meio, num processo denominado ionização do ácido (Figura 2).
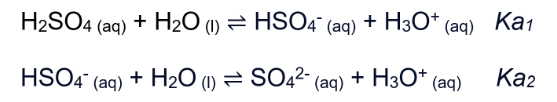
Figura 2. Ionização do ácido sulfúrico.
Além disso, o ácido sulfúrico é uma substância polar com geometria molecular tetraédrica. Pela sua polaridade, possui momento de dipolo não nulo e interage bem com outros compostos polares, como a água.
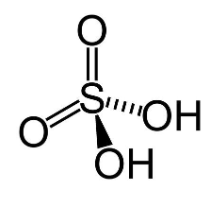
Figura 3. Estrutura tetraédrica do ácido sulfúrico. Fonte: Toda Matéria.
O ácido sulfúrico é conhecido também como uma substância altamente corrosiva e desidratante. Isso significa que é capaz de retirar moléculas de água de compostos com facilidade.
Pelo diagrama de Hommel, apresenta riscos à saúde nível 3 (muito perigoso), riscos de incêndio nível 0 (não queima) e reatividade nível 2 (reação violenta). Além disso, o diagrama informa também que o risco específico dessa substância é “corrosivo”, conforme mostra a Figura 4.
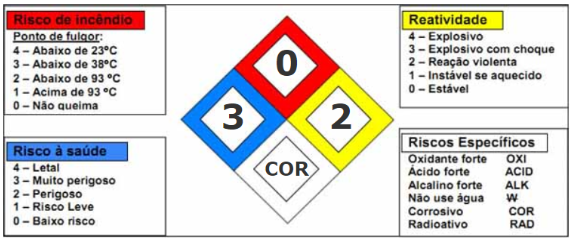
Figura 4. Diagrama de Hommel do ácido sulfúrico. Fonte: Intralab Unesp.
Industrialmente, o ácido sulfúrico é produzido pelo chamado “método de contato”. Este processo é dividido em 4 etapas: a obtenção do enxofre, a formação de SO2 (dióxido de enxofre), a transformação em SO3 (trióxido de enxofre) e, por fim, a absorção em água. Esse processo é capaz de gerar ácido sulfúrico em concentração de até 98%, e as reações envolvidas são mostradas na Figura 5.
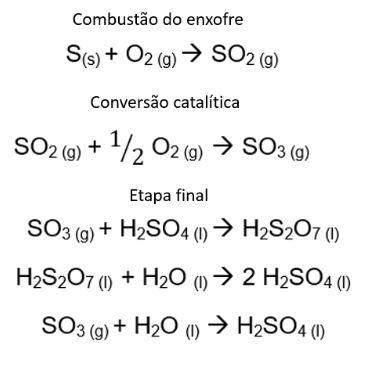
Figura 5. Produção do ácido sulfúrico pelo método de contato.
Aplicações
Conforme mencionado anteriormente, o ácido sulfúrico é uma substância muito versátil, e é usado para a obtenção de diversos produtos. Algumas das principais aplicações desse ácido são na fabricação de fertilizantes e corantes, na síntese de outros produtos químicos (como o ácido fosfórico), na produção de polímeros (como o nylon), no processamento de minérios e na fabricação de explosivos. Já na metalurgia dos metais preciosos, o ácido sulfúrico é muito usado na limpeza de cadinhos e barras acabadas após o processo de fundição, uma vez que estes muitas vezes ficam com uma camada de bórax na superfície.
No processo de refino, o ácido sulfúrico também apresenta aplicações interessantes. Ele pode ser usado na redução de AgCl (cloreto de prata) com ferro e na neutralização do excesso de hidróxido de sódio na metalização da prata com açúcar, por exemplo. Abaixo, explicaremos um pouco mais desses processos.
Redução do cloreto de prata com ferro
Nesse processo, o ferro é usado para reduzir os metais por diferença de potencial presentes na solução. Nesse caso, já que a prata é um metal mais nobre do que o ferro, é capaz de receber elétrons e reduzir, saindo de sua forma +1 no AgCl e formando a prata metálica (Ag0). Geralmente, o ferro é adicionado em excesso nesta etapa e, por isso, adiciona-se ácido sulfúrico, que oxida o metal formando sulfato de ferro (III), retirando o sólido do sistema e diminuindo a possibilidade de contaminação da prata por pedaços de ferro metálico.
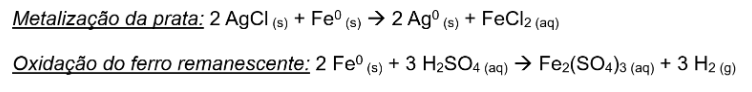
Figura 6. Reações químicas envolvidas no processo.
Metalização da prata com açúcar
Durante o refino da prata, uma das etapas finais é a metalização da prata pura. Para isso, realiza-se normalmente um processo que forma óxido de prata (Ag2O). Ele o reage com açúcar (C6H12O6), para reduzi-lo e formar Ag0. Para tanto, é usado hidróxido de sódio (NaOH), que transforma o cloreto de prata (AgCl) em Ag2O. No entanto, o excesso de base pode afetar os processos posteriores e, por isso, adiciona-se uma pequena quantidade de ácido sulfúrico para neutralizar esse composto. As reações químicas estão descritas abaixo.
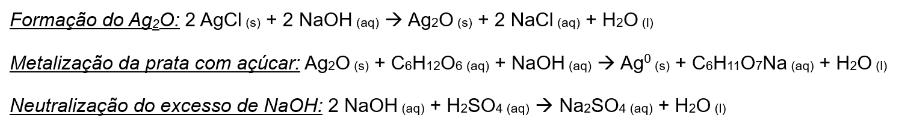
Figura 7. Reações químicas envolvidas no processo.
É válido ressaltar que esse ácido, por ser muito perigoso e corrosivo, deve ser manuseado por profissionais devidamente protegidos utilizando equipamentos de proteção individal (EPIs) adequados, como jaleco, óculos de proteção e luvas nitrílicas.
Siga-nos no Instagram (@8_metais) e curta nossa página no Facebook (8metais) para mais conteúdos como esse!





Comentários