Eletrorefino: a técnica que permite purificar metais a partir da energia elétrica
O refino de metais, utilizado para obter metais com grau de pureza elevado, é normalmente lembrado pelo uso de técnicas tradicionais químicas, como múltiplas precipitações e filtrações. Contudo, um método que utiliza energia elétrica também pode purificar metais a teores elevados: o eletrorefino.
Para que é usado?
O eletrorefino é realizado para purificar metais, ou seja, retirar impurezas que possam estar contaminando o composto de interesse. Normalmente, essa técnica é empregada para refinar metais que já foram concentrados anteriormente, fazendo com que o metal aumente para 99,99% de pureza, aproximadamente. Outra aplicação mais específica do eletrorefino é a purificação do metal aglomerador, o qual possui metais preciosos em sua composição. Nesse caso, a ideia é obter o metal aglomerador com pureza ainda maior e gerar uma massa em pó de metais preciosos no fundo do recipiente.
Um exemplo é o eletrorefino do cobre 95%, proveniente de resíduos como joias e eletrônicos. Durante o processo, a barra do cobre com impurezas é dissolvida, e os íons Cu2+ na solução eletrolítica são depositados no outro polo, gerando assim o cobre eletrolítico (puro) e um lodo anódico que contém metais preciosos, os quais podem, posteriormente, ser recuperados.
O processo de eletrorefino
O princípio do funcionamento do método de eletrorefino é a eletrólise – processo no qual uma fonte de energia elétrica força a ocorrência de uma reação química. Para o seu funcionamento apropriado, é montada uma cuba de eletrorefino, na qual ficam os polos positivo (ânodo) e negativo (cátodo), uma solução eletrolítica feita com os sais do metal que se deseja purificar e uma fonte externa de energia elétrica (Figura 1).
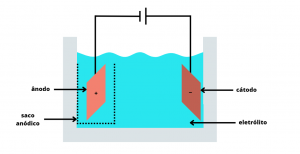
Figura 1. Esquema simplificado da composição de uma cuba de eletrorefino.
Para exemplificar o funcionamento desse processo, vamos supor que se queira purificar um resíduo de cobre que contém prata como impureza.
Nesse caso, o primeiro passo é fundir todo esse metal e lingotá-lo em uma chapa com área superficial elevada (pois assim a duração do processo é reduzida). Feito isso, a cuba é preparada a partir de um material não condutor (como vidro ou plásticos), seguida da adição do metal cobre preparado anteriormente (ânodo), uma placa fina de aço inoxidável, titânio ou de cobre eletrolítico (cátodo) e o eletrólito, composto por soluções de sulfato de cobre II pentahidratado e aditivos que garantirão o nivelamento do depósito no cátodo. Para facilitar a coleta do lodo anódico, coloca-se um saco anódico ao redor do polo positivo.
Assim, quando a corrente contínua é acionada, o processo é iniciado: o cobre impuro do ânodo sofre oxidação e se transforma em íons de Cu2+, os quais passam para a solução eletrolítica e são atraídos para o cátodo, onde sofrem redução e formam novamente Cu0 na placa de cobre puro. Já a prata – que possui potencial de oxidação baixo – permanece no estado sólido e se deposita no fundo da cuba. Expressando o processo na forma de equações químicas, temos:

Figura 2. Reações envolvidas no processo de eletrorefinamento de cobre.
Dessa forma, ao final do processo, observa-se um aumento de massa no cátodo devido à deposição de cobre, e uma diminuição da massa do ânodo por conta da oxidação do cobre impuro. A esquematização de todo o mecanismo de funcionamento pode ser observada abaixo (Figura 3):
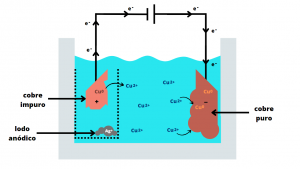
Figura 3. Processo de eletrorefino do cobre.
Algumas outras aplicações, vantagens e desvantagens do método
Além do eletrorefino do cobre 95%, esse método de purificação de metais também é aplicado em compostos como alumínio, níquel, ferro, estanho, ouro e prata, o que verifica a sua versatilidade e possibilidade de aplicação. Ainda, é possível ter uma certa ideia de quais metais serão encontrados em cada lodo anódico proveniente do eletrorefino de certos compostos, conforme listado abaixo:
- Eletrorefino do cobre: prata, ouro, chumbo e metais do grupo da platina.
- Eletrorefino do ouro: ouro em pó, ósmio e cobre, além de platina e paládio no líquido.
- Eletrorefino da prata: ouro e outros metais do grupo da platina.
Porém, apesar de apresentar todas essas qualidades, é válido ressaltar que o método não é isento de desvantagens, das quais são decorrentes de problemas como o acúmulo de impurezas no eletrólito, curtos-circuitos elétricos e a passivação do ânodo em elevadas correntes (a qual dificulta a oxidação do cobre impuro e sua passagem para a solução eletrolítica), por exemplo. Além disso, outra desvantagem – expressiva principalmente no eletrorefino de metais preciosos – é a necessidade da presença dos cátions do metal que se deseja purificar na solução eletrolítica, levando ao aumento do custo do processo, já que soluções de sais de ouro e prata costumam ter maior valor de aquisição.
Siga-nos no Instagram (@8_metais) e curta nossa página no Facebook (8metais) para mais conteúdos como esse!





Comentários