O que é o gás marrom na corrosão de metais?
Durante a corrosão de metais com ácido nítrico ou aqua régia há a formação de um gás marrom que sai da reação. Devido a coloração desse gás, muitas pessoas podem achar que é o cobre presente nas ligas que estão sendo corroídas que está evaporando, porém isso está muito longe de ser verdade. O gás marrom formado nessas reações trata-se do dióxido de nitrogênio (NO2).

Figura 1. Formação de gás marrom na corrosão de metais.
Juntamente com o óxido nítrico (NO) e o óxido nitroso (N2O), o NO2 é um dos diversos óxidos de nitrogênio e se encontra na forma gasosa. Ele é formado na combustão em motores, na queima de querosene e também na reação de ácido nítrico com alguns metais.
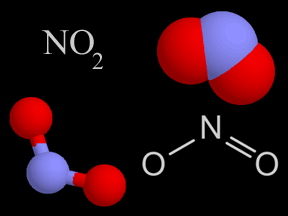
Figura 2. Representações do dióxido de nitrogênio.
Como dito anteriormente, o NO2 é formado na reação do ácido nítrico com alguns metais. Como a aqua régia é formada pela mistura dos ácidos clorídrico e nítrico, também ocorre a formação do gás na corrosão de metais com ela. A reação química que ocorre é a expressa abaixo:
![]()
Esse gás possui uma coloração vermelho-marrom e é muito tóxico, sendo muito irritante aos pulmões e capaz de diminuir a resistência à infecções respiratórias, portanto, é de extrema importância o uso de equipamentos de segurança e de um sistema de exaustão adequados ao trabalhar no refino de metais.
Mas e o cobre?
Se na liga que sofrer a corrosão por ácido nítrico ou aqua régia possuir cobre, ele também vai ser dissolvido e estará presente na solução. Diferente do que a maioria das pessoas pensam, a coloração azul que a solução assume durante a corrosão de algumas ligas não se trata da prata, mas sim do cobre dissolvido nela.

Figura 3. O cobre é responsável pela coloração azul da solução resultante da liga corroída.
Mas se o cobre dissolvido fica azul, que cor fica a prata?
O nitrato de prata (prata dissolvida em ácido nítrico) é incolor! Como a liga de prata dissolvida em ácido nítrico normalmente tem cobre na sua composição, essa confusão é comum. Aqui abaixo temos uma foto do cloreto de prata precipitando de uma solução de nitrato de prata incolor, provando que a solução contendo esse composto é transparente.

Figura 4. Cloreto de prata precipitando de uma solução incolor de nitrato de prata.
Aproveitando a desmitificação da corrosão de metais feita nesse post, muitas pessoas relatam que somente o ácido nítrico não consegue corroer a prata sozinho e muitas vezes adicionam álcool para a reação ocorrer. Porém, elas também fazem a corrosão em temperatura ambiente e com vidrarias que não suportam aquecimento.
O ácido nítrico é sim capaz de dissolver a prata sozinho, contudo é necessário o aquecimento da solução para que isso ocorra mais rápido. Em temperatura ambiente a reação pode não ocorrer ou levar muito tempo. O que acontece ao adicionar álcool junto do ácido nitríco é o que chamamos de uma reação exotérmica, ou seja, a reação entre esses dois compostos libera energia em forma de calor e, esse calor liberado é suficiente para que o ácido nítrico dissolva a prata.






Comentários